A HUN-REN KOKI kutatói által felfedezett új molekuláris szerveződési alapelv közelebb visz a kannabisz hatásának megértéséhez
A kannabisz rendszeres fogyasztását kísérő tolerancia jelenségének molekuláris szintű megértését is segíti a HUN-REN Kísérleti Orvostudományi Kutatóintézet (HUN-REN KOKI) új tanulmánya. A Katona István és munkatársai által kidolgozott módszer lehetővé teszi az élettani folyamatok hátterében álló molekuláris szerveződés vizsgálatát az idegsejteket összekapcsoló szinapszisokban. Ennek segítségével felfedezték, hogy a kannabinoid receptorok térbeli elhelyezkedése hogyan szabályozza a szinapszisok hatékonyságát. A kannabisz hatóanyaga ezt a nanométer pontosságú rendezettséget változtatja meg, ezzel befolyásolva a szinapszisok erősségét. A Barti Benjámin doktorandusz elsőszerzőségével készült tanulmány az egyik legrangosabb tudományos folyóirat, a Science Advances májusi számának címlapjára került.
Agyunk 86 milliárd idegsejtje körülbelül 100 trillió szinapszison keresztül kommunikál egymással. A szinapszisok működésének hatékonysága térben és időben folyamatosan változik, ami rendkívül fontos idegrendszerünk kódolási folyamataiban. A szinapszisok klasszikus működési elve alapján az egyik idegsejt szinaptikus ingerületátvivő anyagokat küld a másik idegsejtnek, ezzel befolyásolva működését. A szinapszisok erősségének beállításában fontos szerepet játszanak a visszacsatolási mechanizmusok, amelyek segítségével a fogadó idegsejt visszajelez az első idegsejtnek. A leggyakoribb szinaptikus visszacsatolási mechanizmus felfedezése váratlanul történt, és fontos szerepet játszottak benne a HUN-REN KOKI kutatói. Első cikkük 25 évvel ezelőtt jelent meg a neves amerikai Journal of Neuroscience folyóiratban, és azóta az egyik legtöbbet hivatkozott tanulmány a hazai laboratóriumokban készült publikációk közül. Katona István és Sperlágh Beáta fiatal kutatóként a Freund Tamás és Vizi E. Szilveszter által vezetett kutatócsoportokban elsőként bizonyította kísérleti úton, hogy a kannabisz hatóanyagának receptora az idegvégződéseken található, és gátolja az ingerületátvivő anyagok felszabadulását. Eredményeik alapján már 1999-ben megjósolták, hogy a kannabinoid receptorok élettani szerepe a szinapszisok visszacsatolási folyamatainak szabályozása.
Ezt a hipotézist később számos kutatócsoport igazolta, és a HUN-REN KOKI kutatói az elmúlt két évtizedben jelentős szerepet játszottak az úgynevezett retrográd endokannabinoid-jelpálya molekuláris és anatómiai szerveződésének feltárásában, élettani és kórélettani jelentőségének felfedezésében. Azonban egy fontos alapkérdés máig megoldatlan maradt. Mi szabályozza, hogy egy adott szinapszisban milyen erős a visszacsatolás, azaz milyen mennyiségi szerveződési alapelveken alapul a retrográd szinaptikus jelátvitel erőssége?
- Az evolúció során alakult ki a kannabinoid-jelpálya
A kannabisznövény által termelt pszichoaktív hatóanyag, a THC-molekula egy receptorfehérjéhez, a kannabinoid receptorhoz kapcsolódva fejti ki idegrendszeri hatásait. Érdekes módon idegsejtjeink olyan jelmolekulákat, belső kannabinoidokat, más néven endokannabinoidokat termelnek, amelyek ugyanehhez a receptorhoz kapcsolódnak. Az endokannabinoid-jelpálya nagyon régen kialakult az evolúció során: a kannabinoid receptor ősi változata, valamint az endokannabinoid-jelmolekulákat elkészítő és lebontó enzimfehérjék már a medúzákban is előfordulnak. Ez arra utal, hogy e belső jelpályának alapvető élettani szerepe van. A legfontosabb különbség az endokannabinoidok és a növény által termelt THC hatása között, hogy idegsejtjeink ezredmásodperces és nanométeres pontossággal akkor és ott használják az endokannabinoid-jelmolekulákat, amikor és ahol élettanilag szükség van rájuk. Ezzel szemben a THC az egész idegrendszert elárasztva egyszerre sok milliárd szinapszis működését változtatja meg a kannabiszhasználat során.
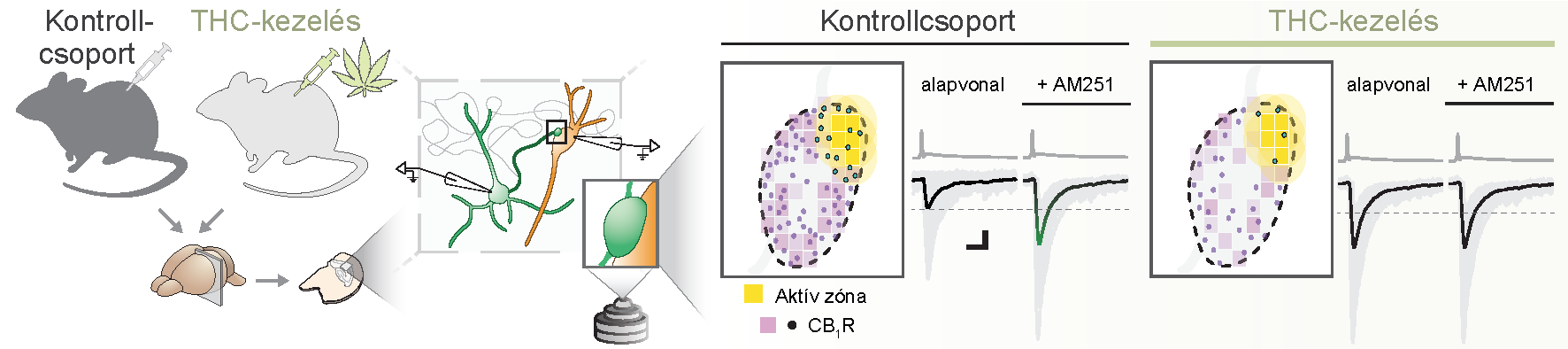
A tanulmányban végzett kísérletek sematikus illusztrációja. A kutatók kontroll- és THC-kezelt egércsoportokat vizsgáltak. A kezelést követően az egerek agyából túlélő agyszeleteket készítettek, majd az ezekben lévő sejteken végeztek elektrofiziológiai és szuper-rezolúciós mikroszkópos méréseket. Az eredményekből az látszott, hogy a THC-kezelés hatására a kannabinoid receptorok nanoskálájú elrendeződése megváltozott, ami magyarázhatja a fiziológiai kísérletekben megfigyelt változásokat.
A tudományos probléma nehézségének oka, hogy egy átlagos idegvégződés csupán 1 mikrométer átmérőjű, az idegsejtek közötti szinaptikus rés pedig mindössze 10 nanométer, azaz a milliméter százezred része. Ezért a klasszikus fénymikroszkópos eljárásokkal nagyon nehezen vizsgálható a szinapszisok molekuláris szerveződése. Katona István és munkatársai a Nature Neuroscience és a Nature Protocols folyóiratokban 2015-ben és 2016-ban mutattak be egy szuper-rezolúciós mikroszkópián alapuló munkafolyamatot, amely először tette lehetővé egy azonosított idegsejttípus szinapszisaiban a jelátviteli folyamatok hátterében álló molekulák mennyiségének nanométeres pontosságú mérését. Új tanulmányukban ezt a munkafolyamatot fejlesztették tovább. Kidolgoztak egy eljárást, amelynek segítségével a két idegsejtet összekötő szinapszisban megmérték a jelátvitel erősségét, majd szuper-rezolúciós mikroszkóppal nanométeres pontossággal meghatározták a jelátvitelben szerepet játszó molekulák térbeli elhelyezkedését. Kísérleteik során egy speciális szinaptikus jelenséget vizsgáltak, az úgynevezett kannabinoid tónust. A Nobel-díjas Thomas Südhof csoportjának 2013-as felfedezése alapján az autizmus egyik genetikai hátterű típusában a kannabinoid tónus nem működik, ezzel szemben a hagyományos endokannabinoid-jelpályák működése nem károsodik. A különbség oka ismeretlen maradt.
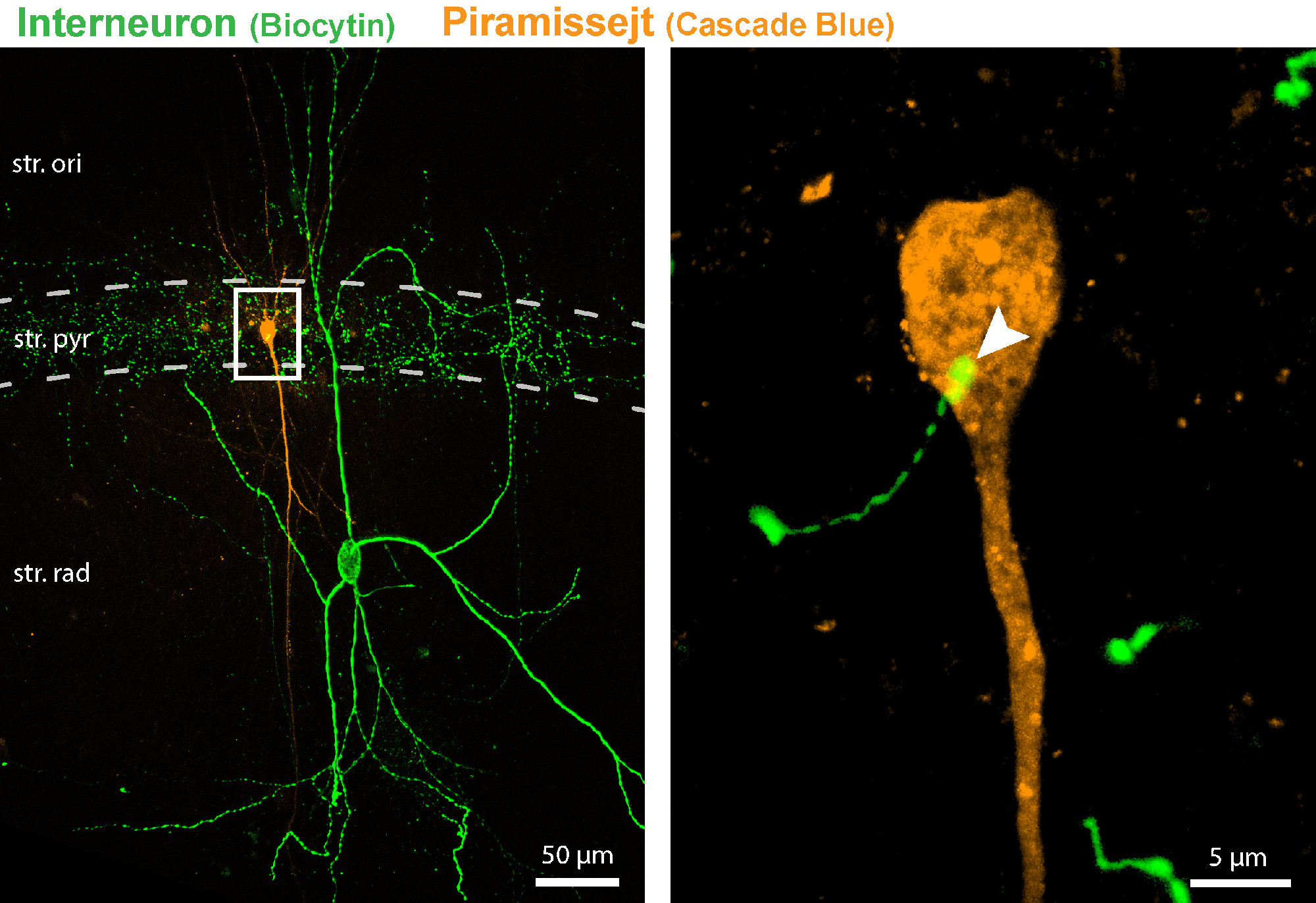
Konfokális mikroszkópos felvétel egy vizsgált preszinaptikus interneuron (zöld) és posztszinaptikus piramissejt (narancssárga) sejtpárról, amelyeket fluoreszcens jelölőanyagokkal tettek láthatóvá. A bekeretezett régió a kép jobb oldalán nagyítva látható, és a szinaptikus kapcsolatot mutatja a két sejt között (amit a képen nyílhegy is jelöl).
A HUN-REN KOKI kutatóinak első meglepő megfigyelése alapján ebben a szinaptikus jelenségben nem vesz részt a két klasszikus endokannabinoid-termelő enzim, tehát a kannabinoid tónus hátterében egy új molekuláris mechanizmus szerepel. A következő lépésben a kutatók tesztelték hipotézisüket, amely szerint a kannabinoid receptorok egy csoportja az endokannabinoid-jelmolekulák hiányában is szakadatlanul aktív, így szabályozva a szinapszisok erősségét. Az élettani és molekuláris mérések feltárták, hogy az ingerületátvivő anyagok felszabadulásának 200 nanométeres környezetében tónusosan aktív kannabinoid receptorok száma valóban alapvetően befolyásolja az idegsejtek közötti szinaptikus kommunikáció erősségét. Végül megvizsgálták, hogy egy hat napig tartó kezelés a kannabisz pszichoaktív hatóanyagával hogyan befolyásolja a kannabinoid receptorok nanométeres pontosságú rendezettségét egerekben. Azt tapasztalták, hogy az ingerületátvivő anyagok felszabadulási helyének 200 nanométeres környezetében a kannabinoid receptorok száma a felére csökkent. Ezzel párhuzamosan a kannabinoid tónus jelensége teljesen eltűnt a szinapszisokból, miközben a klasszikus endokannabinoid-jelpálya működése nem változott jelentősen. Ez a váratlan eredmény felhívja a figyelmet, hogy a kannabisz számos hatása közül lehet olyan, amelynek hátterében hasonló molekuláris változások állhatnak, mint az autizmus spektrumzavar egyik genetikai formájában.

