A KOKI kutatói a pajzsmirigyhormon agyi transzportját vizsgálva alaptudományi és transzlációs szempontból egyaránt jelentős eredményeket értek el
Az ELKH Kísérleti Orvostudományi Kutatóintézet (KOKI) csoportvezetői, Dr. Gereben Balázs és Dr. Fekete Csaba innovatív kutatási eszközt fejlesztettek ki a pajzsmirigyhormon (PMH) jelátvitelének sejttípus-specifikus vizsgálatára. A rangos eLife folyóiratban most megjelent tanulmányukban a kutatók arról számolnak be, hogy szabadalmaztatott egérmodelljük segítségével elért úttörő eredményeik egyes vonatkozásai a pajzsmirigy-alulműködés (hipotireózis) kezelését is érintik.

1. ábra: Kétkomponensű mikrofluid primer idegsejt-kultúrák a T3-szállítódás vizsgálatához. A mikrokapillárisokon keresztülnövesztett axonok lehetővé teszik ugyanazon sejt sejttestjének és axonvégződésének funkcionális elkülönítését és ezáltal a köztük zajló anyagforgalom vizsgálatát.
A PMH gyakorlatilag minden szövetben a sejtműködés egyik fő szabályozója. A PMH különösen fontos szerepet játszik az agy működésének szabályozásában. A véráram keringő PMH-szintje viszonylag stabil, ami éles ellentétben áll a PMH-szintek különböző szövetekben és sejttípusokban tapasztalható turbulens és gyors változásaival. Ezek a változások elengedhetetlenek ahhoz, hogy a szövetspecifikus PMH-jelátvitel megfeleljen a szövetek térben és időben is gyorsan változó PMH-igényének.
Az agy PMH-háztartása különösen összetett, mivel ez a szerv a PMH szabályozója és célpontja is egyben. Mindeddig megoldatlan kérdés volt, hogy a T3, a PMH aktivált formája, hogyan jut el célpontjaihoz, hogy kiváltsa az agyban biológiai hatását. Leginkább az a nézet terjedt el, hogy ez parakrin módon történik, azaz a gliasejtek a T4 prohormonból T3-at előállítva látják el a szomszédjukban található neuronokat.
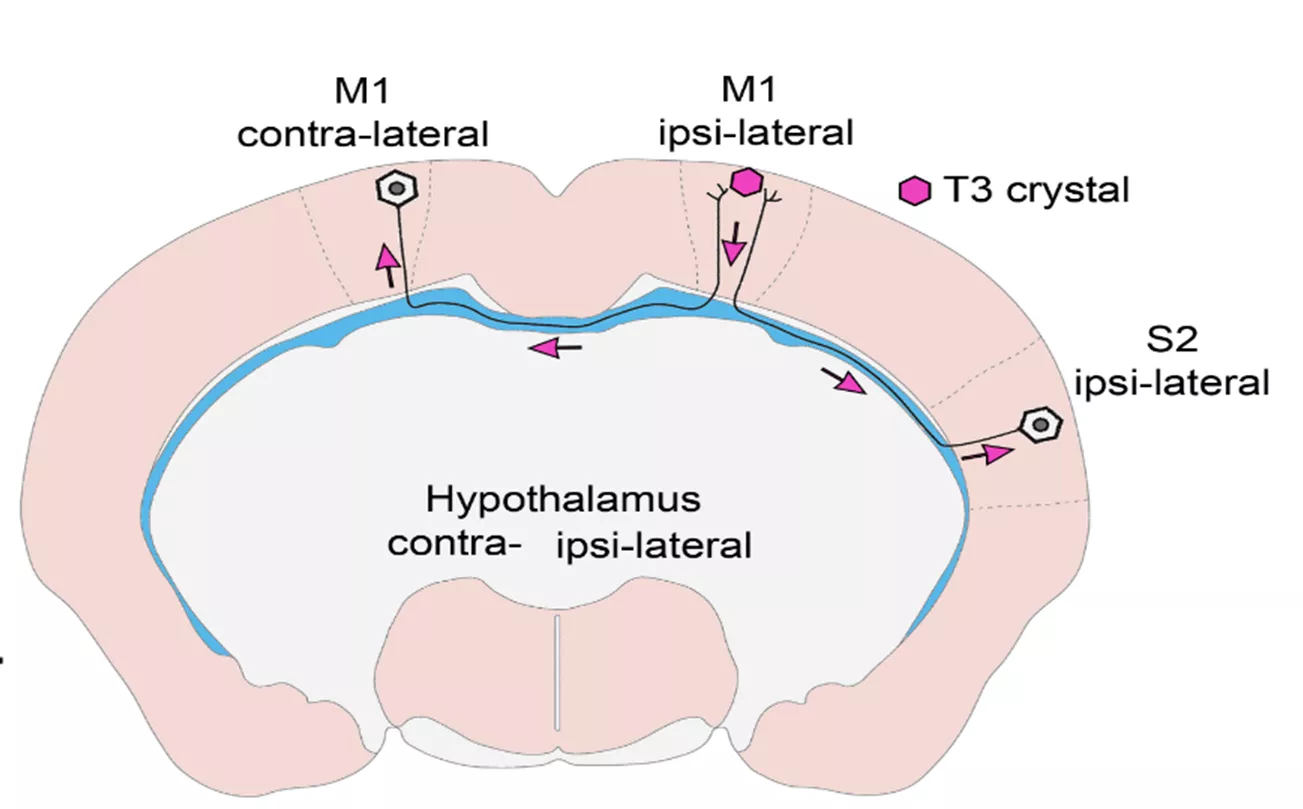
2. ábra: A T3-vándorlás tanulmányozása a pajzsmirigyhormon-hatás mérésére szolgáló indikátor egér agyában. A THAI-egerek M1 agykérgi régiójába helyezett (kristályból felszabaduló) T3 az interhemiszférikus axonokon keresztül átjut a másik féltekébe, ahol a kontralaterális M1 régióban transzkripciós hatást vált ki, míg a régióval közvetlen összeköttetésben nem álló hipotalamuszban ilyen hatás nem mutatható ki.
A kutatóknak összetett in vitro és in vivo kísérletek sorozatával sikerült bizonyítaniuk, hogy a T3 retrográd módon, az idegsejtek axonnyúlványaiban utazva éri el az idegsejtek sejtmagját olyan hólyagocskákban (vezikulákban), amelyek megvédik a hormont az idegsejtekben nagy mennyiségben található T3-bontó enzimtől. Kimutatták, hogy a PMH-jelátvitel az agyban sokkal összetettebb, mint korábban gondolták. Az agykéregben keletkező T3 a hosszú, agyféltekéket összekötő (interhemiszférikus) axonokon keresztül eljuthat a másik oldali agykéregbe is, így távol eső agyi régiók szabályozhatják egymás PMH-függő sejtaktivitását. Ezek a vizsgálatok arra a sokáig megoldatlan kérdésre is választ adtak, hogy a hipotalamusz-hipofízis-pajzsmirigy (HHP) tengelyt szabályozó idegsejtcsoport, azaz a hipotalamusz hipofiziotróp TRH-neuronjai hogyan kapják a T3-bemenetet a perifériás keringésből és a tanicitákból, a hipotalamusz PMH-aktiváló sejtjeiből. Ez az egész testre hatással van, mivel a TRH-neuronok PMH által kiváltott negatív visszacsatoláson alapuló szabályozása a HHP-tengely egyik kulcsfontosságú szabályozási mechanizmusa. Az eredmények transzlációs vonatkozása is jelentős, mivel megmagyarázza, hogy a hipotireózis ‒ pajzsmirigy-alulműködés/-hiány ‒ miatt alkalmazandó hormonpótló terápia során egyelőre még ritkán alkalmazott T4+T3 kombinációs terápia T3 komponense miért képes túlélni az agy T3-lebontó aktivitását. Ez előnyös lehet olyan PMH-pótlásban részesülő betegek számára, akik nem reagálnak jól a T4-monoterápiára.
A T3 agyban történő terjedésének tanulmányozására egyedülálló lehetőséget biztosított a magyar, európai uniós és USA-szabadalommal védett, Gereben Balázs és Fekete Csaba kutatócsoportjainak közös munkájával kifejlesztett pajzsmirigyhormon-hatás mérésére szolgáló (Thyroid Hormone Action Indicator, THAI) transzgenikus egérmodell.
Az USA Nemzeti Egészségügyi Intézete (NIH) által támogatott kutatás (NIDDK R01DK058538) Dr. Antonio C Bianco Chicagói Egyetemen működő csoportjával közösen valósult meg. A magyar és az amerikai kutatócsoport között az első és az utolsó szerzőség is megosztott.
Publikáció:
Federico Salas-Lucia, Csaba Fekete, Richárd Sinkó, Péter Egri, Kristóf Rada, Yvette Ruska, Balázs Gereben, Antonio C Bianco (2023). Axonal T3 uptake and transport can trigger thyroid hormone signaling in the brain. eLife, May 19, 2023. DOI: 10.7554/eLife.82683

