A HUN-REN Kísérleti Orvostudományi Kutatóintézet (HUN-REN KOKI) Dr. Gereben Balázs által vezetett Molekuláris Sejt Metabolizmus Kutatócsoportja a központi idegrendszeri gliasejtek osztódását tanulmányozva egy olyan új molekuláris mechanizmust tárt fel, amelynek szerepe lehet emberi gliómadaganatok kialakulásában. Az eredményeket bemutató, Dr. Mohácsik Petra elsőszerzőségével készült tanulmány a Journal of Biological Chemistry c. folyóiratban jelent meg.
Az idegrendszer felépítésében az idegsejtek mellett gliasejtek vesznek részt. Ezek kulcsfontosságú altípusa az agy leggyakoribb sejtje, az asztrocita, amely minden agyrégióban jelen van, és alapvető szerepet játszik az idegi működés megfelelő feltételeinek biztosításában. A gliasejtek működését többek között hormonális útvonalak szabályozzák. A pajzsmirigyhormon (PMH) például a sejtosztódás és a sejtműködés kritikus szabályozója. A vérben lévő PMH-szint viszonylag állandó, a szöveti PMH-jelátvitel viszont egy sejttípus-specifikus mechanizmus hatásának megfelelően változik. A PMH-jelátvitel kritikus mozzanata a pajzsmirigy által termelt tiroxin (T4) előhormon aktiválása T3-má, ami már képes a PMH-receptorhoz kötődni. Ezt a reakciót az agyban a kettes-típusú dejodáz (D2) szelenoenzim katalizálja.
A HUN-REN KOKI kutatói egy olyan új molekuláris mechanizmust azonosítottak, ami a D2 enzim szabályozásán keresztül határozza meg a T3 hormon elérhetőségét az agy gliasejtjeiben. A D2 mRNS-ének szokatlanul hosszú, 3'UTR régiója nem vesz részt a D2 fehérje kódolásában, hanem szabályozó tényezők célpontjául szolgál. A kutatók molekuláris biológiai technikák segítségével bizonyították, hogy egy sejtciklus-szabályozó fehérje, a Musashi-1 (MSI1), közvetlenül kötődik ehhez az mRNS régióhoz. Azt is kimutatták, hogy e folyamat sejtkultúrákban, többek között humán glióma sejtekben is, csökkenti a D2 aktivitását, ezáltal pedig az enzim T3-előállító képességét. Eredményük rámutatott, hogy szoros molekuláris kapcsolat áll fenn a sejtosztódást serkentő MSI1 és a differenciálódást (azaz a sejtek különféle irányokba történő specializációját) támogató T3 képződése között.
Egér agyban végzett in vivo vizsgálatokkal igazolták az MSI1 és a D2 enzim együttes jelenlétét, ezzel a kapcsolat morfológiai alapját gliális elemekben, míg az MSI1-D2 útvonal működőképességének közvetlen bizonyítékát egy MSI1-hiányos transzgenikus egérmodell szolgáltatta.
Az érett asztrociták felnőtt agyban nem osztódnak, azonban bizonyos körülmények között (pl. fokális iszkémia, traumás agysérülés vagy agydaganat), őssejtszerű tulajdonságokat nyernek vissza, beleértve az osztódóképességet is. Az asztrocitómák és a glioblasztómák az agy gliasejtekből származó rosszindulatú daganattípusai. Ezért különösen jelentős az a megfigyelés, hogy amikor a kutatók az MSI1-D2 útvonalat modulálva, az MSI1 szint csökkentésével a D2 aktivitást növelték, ez a PMH jelenlététől függő módon 56%-kal tudta lassítani az asztrociták osztódását, ami egyúttal bizonyította az MSI1-D2-T3 útvonal szerepét az asztrocita sejtciklus szabályozásában.
A Dr. Fekete Csaba (HUN-REN KOKI) és Dr. AC Bianco (University of Chicago, IL USA) csoportjainak közreműködésével elért eredmény, az MSI1-D2-T3 útvonal, mint az asztrociták osztódásának új molekuláris szabályozási mechanizmusa, potenciálisan befolyásolhatja az emberi gliális daganatok fejlődését. A munkát az USA Nemzeti Egészségügyi Intézete, valamint a Nemzeti Transzlációs Idegtudományi Laboratórium és a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal támogatta.
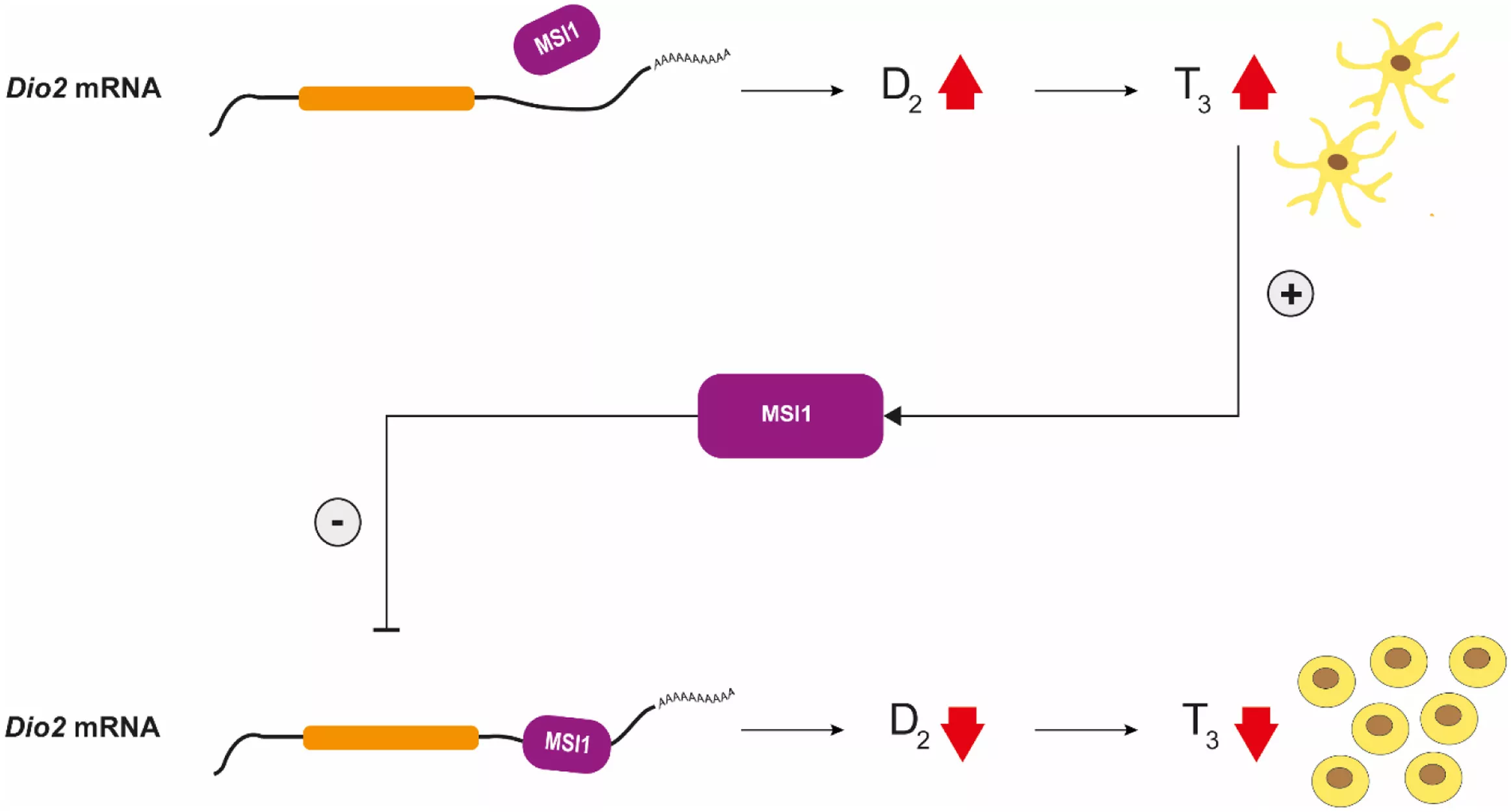
Az MSI1-D2-T3 útvonal sematikus ábrázolása. Az MSI1 kötődése a D2 mRNS 3'UTR régiójához csökkenti a D2 enzim által katalizált T3-termelődést az agykéreg asztrocita sejtjeiben és elősegíti e sejtek osztódását. A keletkező T3 növeli az MSI1 szintjét, és ily módon negatív visszacsatolást gyakorol a D2-mediált T3-termelésre.